От рибоксина может болеть желудок

ВЛИЯНИЕ РИБОКСИНА НА СЛИЗИСТУЮ ОБОЛОЧКУ ЖЕЛУДКА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХРОНИЧЕСКОМ АТРОФИЧЕСКОМ ГАСТРИТЕ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Жураковский И.П.
1
Сергеева Я.С.
1
Аутеншлюс А.И.
1
1 ГБОУ ВПО Новосибирский государственный медицинский университет Министерства здравоохранения Российской Федерации
Проведено морфологическое исследование желудка крыс-самцов Wistar после получения модели хронического атрофического гастрита с помощью введения 2 % раствора салицилата натрия в 30 % растворе спирта в течение 8 недель и содержания на альтернативном посту, а также введения раствора рибоксина в дозе 20 мг/кг. Показано, что введение рибоксина приводит к снижению выраженности воспалительного процесса (отсутствует слущивание эпителиальных клеток и расширение венозных сосудов, значительно уменьшается инфильтрация клеточными элементами собственной пластинки слизистой желудка); восстанавливается слизистая оболочка желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и восстановлением до исходного уровня количества клеток, секретирующих кислые муцины).
хронический атрофический гастрит
модель
рибоксин
морфология
1. Effects of He-Ne laser irradiation on chronic atrophic gastritis in rats / X.H. Shao [et al.] // World J. Gastroenterol. – 2005. – Vol. 25, № 11. – P.3958-3961.
2. Gallo Rolanía F.J. Ultrastructural study of the kidney subjected to warm ischemia and perfused with inosine / F.J. Gallo Rolanía, A.J. Álvarez-Morujo Suarez, F.P. Collía Fernandez // Arch. Esp. Urol. – 2013. – Vol. 66, № 10. – P.945-955.
3. Gastric cancer: prevention, screening and early diagnosis / V. Pasechnikov [et al.] // World J. Gastroenterol. – 2014. – Vol. 20. – P.13842–13862.
4. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading / M. Rugge [et al.] // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P.1249–1259.
5. Haskó G. Trends Immunomodulatory and neuroprotective effects of inosine / G. Haskó, Sitkovsky M.V., Szabó C. // Pharmacol. Sci. – 2004. – Vol. 25, № 3. – P.152-157.
6. Mucin histochemistry of stomach in metaplasia and adenocarcinoma: An observation / P.K. Mandal [et al.] // Indian J. Med. Paediatr. Oncol. – 2013. – Vol. 34, № 4. – P.229-233.
7. Non-invasive diagnosis of gastric mucosal atrophy in an asymptomatic population with high prevalence of gastric cancer / A. Rollan [et al.] // World J. Gastroenterol. – 2006. – Vol. 12. – P.71–72.
8. Serum gastrin 17, pepsinogen I and pepsinogen II in atrophic gastritis patients living in North-East of Iran / M. Hosseini [et al.] // J. Res. Med. Sci. – 2013. – Vol. 18. – P.225.
9. Siegel R. Cancer statistics 2013 / R. Siegel, D. Naishadham, A. Jemal // Cancer J. Clin. – 2013. – Vol. 6. – P.11–30.
Хронический атрофический гастрит (ХАГ), являющийся одним из наиболее распространенных заболеваний органов пищеварения, представляет собой хронический воспалительный процесс, характеризующийся потерей желудочных железистых структур, которые заменяются либо соединительной тканью, либо железистыми структурами, не свойственными для данной локализации [4].
В многочисленных исследованиях показано, что хронический атрофический гастрит является предраковым заболеванием [7;8] и что его лечение имеет важное значение для предотвращения желудочного канцерогенеза [3], приводящего к раку желудка, что является одной из основных причин смертности от онкологических заболеваний во всем мире [9].
Рибоксин (инозин) – относится к группе лекарственных средств, регулирующих метаболические процессы. Этот препарат является предшественником синтеза пуриновых нуклеотидов: аденозинтрифосфата и гуанозинтрифосфата, которые обеспечивают антигипоксический и цитопротекторный эффект [2], что послужило основанием для начала его применения в лечении хронического атрофического гастрита. Вместе с тем механизм влияния рибоксина на данный патологический процесс практически не изучен.
Целью настоящей работы являлось изучение влияния рибоксина на процессы, происходящие в слизистой оболочке желудка при экспериментальном хроническом атрофическом гастрите.
Материал и методы исследования
Эксперимент проведен на 24 половозрелых крысах-самцах Wistar с исходной массой 180–220 г. Для получения модели ХАГ 18-ти экспериментальным животным внутрижелудочно вводили 2 % раствор салицилата натрия в 30 % растворе спирта в течение 8 недель, кроме того, крысы содержались на альтернативном посту (сутки – пост, 2 дня – кормление) со свободным доступом к воде [1]. Экспериментальным животным группы «ХАГ2+Р» в течение третьего месяца внутрижелудочно вводили раствор рибоксина в дозе 20 мг/кг. В качестве контроля использовали интактных животных (группа «Инт»), а также животных, которых не подвергали никакому воздействию в течение 1 месяца после воспроизведения у них модели ХАГ (группа «ХАГ2+1»).
Желудки крыс фиксировали в 12 % формалине. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Морфология слизистой желудка оценивалась при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Общий муцин выявляли муцикармином с последующей докраской ядер гематоксилином Эрлиха. Кислые муцины выявляли альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера.
Анализ относительной площади, занимаемой железами желудка, а также клеточных элементов, относительной площади окрашивания общих и кислых муцинов проводился с помощью светооптического микроскопа и морфометрического комплекса на базе микроскопа Micros MC 300A, цифровой камеры CX 13c («Baumer Electric GmbH», Германия) и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США). Для каждой группы оценивалось по 48 изображений.
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 13.0 for Windows. Для сравнения независимых групп использовали критерий Крускала – Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна – Уитни. Различия между значениями сравниваемых параметров расценивали как статистически значимые при р< 0,05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Результаты исследования и обсуждение
При морфологическом исследовании срезов желудка через 2 месяца после начала введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ 2») было отмечены признаки, характерные для хронического атрофического гастрита. Так, наблюдалось истончение слизистой оболочки желудка, уменьшение желез в размерах с увеличением расстояния между ними, развитие склеротических изменений (рис. 1), отмечалась инфильтрация слизистой желудка как нейтрофильно-лейкоцитарными, так и макрофагальными элементами (таблица 1). При этом выраженность инфильтрации возросла по сравнению с интактными животными в пилорическом отделе в 16,5 раза, в фундальном – в 6,7 раза. Соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2,7 : 1 : 1,3 : 0,3, в фундальном отделе – 2,5 : 1 : 1 : 0. Исследование срезов пилорического отдела желудка позволило выявить, дополнительно к описанным выше изменениям, наличие очагов кишечной метаплазии с бокаловидными клетками (рис. 2).
Найденные при морфологическом исследовании патологические изменения подобны изменениям, наблюдаемым при хроническом атрофическом гастрите у человека [4], что позволяет сделать заключение о правильности воспроизведения модели.
Таблица 1
Морфометрический анализ клеточных элементов инфильтратов слизистой оболочки желудка в % Me (Q1;Q3)
Показатель | Относительная площадь | |||||
Инфильтратов | Нейтрофилов | Лимфоцитов | Моноцитов | Плазматических клеток | ||
Пилорический отдел | инт | 0,77 (0,19;1,54) # | 0,00 (0,00;0,77) # | 0,00 (0,00;0,77) # | 0,00 (0,00;0,00) # | 0,00 (0,00;0,00) # |
ХАГ2 | 12,69 (10,77;15,19) *# | 6,15 (4,62;7,69) *# | 2,31 (1,54;3,08) *# | 3,08 (2,31;3,85) * | 0,77 (0,00;0,77) *# | |
ХАГ2+1 | 10,77 (10,00;13,08) * | 4,62 (3,85;6,15) * | 2,31 (1,54;2,31) * | 3,08 (2,31;3,85) * | 0,77 (0,77;1,54) * | |
ХАГ2+Р | 8,46 (6,92;9,81) *# | 4,62 (3,85;5,38) * | 1,54 (0,77;1,54) *# | 2,31 (1,54;2,31) *# | 0,00 (0,00;0,77) *# | |
Фундальный отдел | инт | 2,31 (1,54;3,08) # | 0,88 (0,77;1,54) # | 0,77 (0,19;1,54) # | 0,77 (0,00;0,77) # | 0,00 (0,00;0,00) # |
ХАГ2 | 15,38 (13,08;16,73) *# | 7,69 (6,15;8,46) *# | 3,08 (2,50;3,85) *# | 3,08 (2,31;3,85) * | 0,77 (0,77;1,54) *# | |
ХАГ2+1 | 12,31 (10,77;13,65) * | 5,38 (4,62;6,15) * | 3,08 (2,31;3,65) * | 3,08 (2,31;3,08) * | 0,77 (0,00;0,77) * | |
ХАГ2+Р | 9,23 (7,88;10,00) *# | 4,62 (3,85;5,38) *# | 1,54 (1,54;2,31) *# | 2,31 (1,54;3,08) *# | 0,77 (0,00;0,77) * | |
Примечание:
* – достоверные отличия по сравнению с группой Инт при p < 0,05;
# – достоверные отличия по сравнению с группой ХАГ2+1 при p < 0,05.
Отмеченное существенное увеличение общих муцинов, и в частности кислых их фракций, как в фундальном, так и пилорическом отделах желудка (таблица 2), что наблюдается при ХАГ [6] также может служить дополнительным признаком адекватности полученной модели.
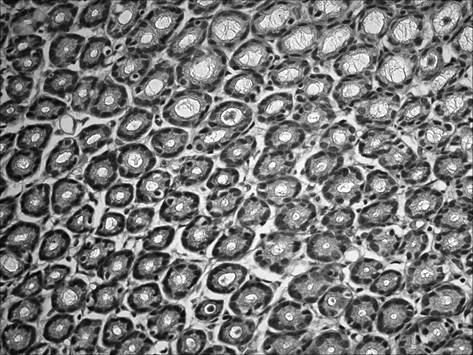
Рис. 1. Слизистая фундального отдела желудка через 2 мес. после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: развитие склеротических изменений. Окр. гематоксилином и эозином, ув. 400
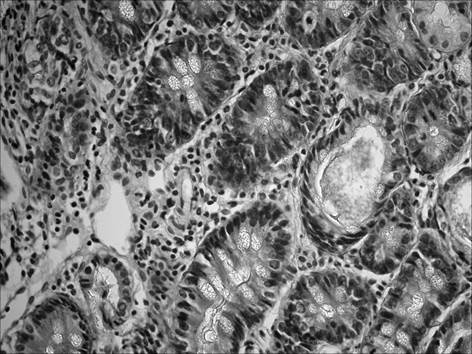
Рис. 2. Слизистая пилорического отдела желудка через 2 мес. после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: наличие очагов кишечной метаплазии с бокаловидными клетками. Окр. гематоксилином и эозином, ув. 400
Таблица 2
Относительная площадь желез, общих и кислых муцинов в % Me (Q1;Q3)
Показатель | Относительная площадь | |||
Желез | Общих муцинов | Кислых муцинов | ||
Пилорический отдел | инт | 70,0 (66,9;71,5)# | 7,5 (5,4;10,7)# | 4,1 (3,1;4,8)# |
ХАГ2 | 13,5 (10,8;16,2) *# | 58,7 (33,2;61,9) *# | 16,5 (13,0;21,1)*# | |
ХАГ2+1 | 31,5 (30,0;33,7) * | 20,4 (18,7;22,8) * | 9,7 (7,3;15,0) * | |
ХАГ2+Р | 47,3 (42,5;49,2) *# | 26,1 (23,0;27,9) *# | 5,0 (3,1;7,3) *# | |
Фундальный отдел | инт | 65,8 (62,3;71,3) *# | 20,7 (18,4;22,9) # | 3,5 (2,4;6,6) # |
ХАГ2 | 27,7 (24,6;35,2) *# | 61,0 (53,3;64,0) *# | 18,0 (14,3;21,1) *# | |
ХАГ2+1 | 43,8 (40,8;47,5) * | 25,0 (22,6;30,8) * | 11,5 (8,2;14,6) * | |
ХАГ2+Р | 50,0 (47,7;51,5) *# | 17,9 (15,2;20,1) *# | 4,1 (2,5;6,6) # | |
Примечание:
* – достоверные отличия по сравнению с группой Инт при p < 0,05;
# – достоверные отличия по сравнению с группой ХАГ2+1 при p < 0,05.
При морфологическом исследовании объектов как фундального, так и пилорического отделов желудка через 1 месяц после окончания введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ2+1»), по сравнению с группой «ХАГ2», отмечалось некоторое снижение активности хронического атрофического гастрита. Прежде всего, было отмечено отсутствие фокусов кишечной метаплазии в пилорическом отделе желудка. Кроме того, отмечалось частичное восстановление желез фундального и пилорического отделов желудка, заключающееся как в достоверном увеличении относительной площади самих желез, так и имеющей место тенденции к восстановлению популяций их клеточных элементов, что подтверждалось достоверным уменьшением относительной площади общего и кислых муцинов (таблица 2). Вместе с тем сохранялась признаки склеротических изменений. Выраженность инфильтрации собственной пластинки слизистой желудка, по сравнению с группой «ХАГ2», была достоверно ниже как в пилорическом, так и в фундальном отделах (таблица 1). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2 : 1 : 1 : 0,33, а в фундальном — 1,75 : 1 : 1 : 0,25.
Данные результаты, вероятно, следует расценивать как подтверждение того, что исключение раздражающего этиологического фактора приводит к некоторому уменьшению воспалительного процесса в слизистой оболочке желудка, однако полного восстановления не происходит, что дает возможность использовать данную модель для изучения длительного приема препаратов.
В отличие от группы «ХАГ2+1», при применении рибоксина (группа «ХАГ 2+Р») отмечалось существенное уменьшение признаков хронического атрофического гастрита. Так, выраженность инфильтрации собственной пластинки слизистой желудка снизилась в пилорическом отделе в 1,5 раза, в фундальном в 1,3 раза (рис. 3). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 3 : 1 : 1,5 : 0, в фундальном отделе – 3 : 1 : 1,5 : 0,5.
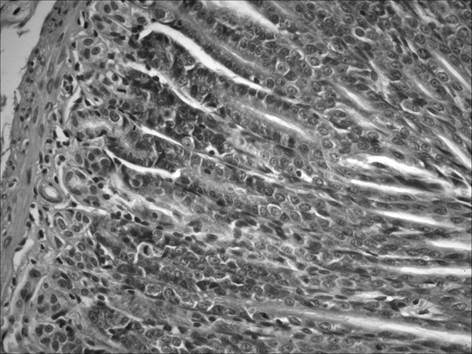
Рис. 3. Слизистая фундального отдела желудка через 1 месяц после окончания введения рибоксина: снижение инфильтрации собственной пластинки нейтрофильно-лейкоцитарными и макрофагальными элементами. Окр. гематоксилином и эозином, ув. 400
Не исключено, что данный эффект рибоксина может быть связан с его способностью влиять на продукцию провоспалительных цитокинов [5]. Кроме того, отмечалось более выраженное, по сравнению с группой «ХАГ2+1», восстановление слизистой оболочки желудка (таблица 2). При применении рибоксина в пилорическом отделе желудка отмечалось достоверное увеличение секреции общего муцина на фоне уменьшения его кислых фракций, а также уменьшение как общего, так и кислых муцинов в фундальном отделе (рис. 4).
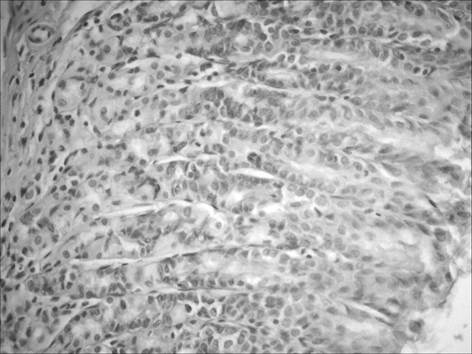
Рис. 4. Слизистая фундального отдела желудка через 1 месяц после окончания введения рибоксина: уменьшение мукоцитов, секретирующих кислый муцин. Окр. альциановым синим при рН=1,0 с последующей докраской ядер кармалюмом Майера, ув. 400
Заключение
Результаты проведенного исследования показали, что применение рибоксина приводит к уменьшению признаков хронического атрофического гастрита, а именно – к снижению выраженности воспалительного компонента ХАГ (отсутствует слущивание эпителиальных клеток и расширение венозных сосудов, значительно уменьшается инфильтрация клеточными элементами собственной пластинки слизистой желудка, преимущественно за счет уменьшения количества лимфоцитов и моноцитов/макрофагов); восстанавливается слизистая оболочка желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и восстановлением до исходного уровня количества клеток, секретирующих кислые муцины).
Библиографическая ссылка
Жураковский И.П., Сергеева Я.С., Аутеншлюс А.И. ВЛИЯНИЕ РИБОКСИНА НА СЛИЗИСТУЮ ОБОЛОЧКУ ЖЕЛУДКА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХРОНИЧЕСКОМ АТРОФИЧЕСКОМ ГАСТРИТЕ // Современные проблемы науки и образования. – 2016. – № 4.;
URL: https://science-education.ru/ru/article/view?id=24941 (дата обращения: 05.01.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Для активизации и нормализации обменных процессов в мышце сердца, а также устранения гипоксии тканей назначается Рибоксин.
Чтобы достичь желаемого эффекта при применении препарата, необходимо детально ознакомиться не только с показаниями, но и с побочными действиями Рибоксина.
Лекарственное средство выпускается в форме:
- твердых желатиновых капсул красного цвета с белым порошком внутри;
- таблеток двух видов;
- раствора для внутривенных инъекций.
В качестве основного ингредиента Рибоксина выступает инозин – нуклеозид, химический предшественник аденозинтрифосфорной кислоты (АТФ), являющейся универсальным источником энергии для всех биохимических процессов в организме.
Проникая в клетку, активный компонент способствует повышению их энергетического баланса и стимулирует синтезирование нуклеозидфосфатов.

Производство Рибоксина осуществляется многочисленными фармацевтическими предприятиями на территории постсоветского пространства
Рибоксин обладает следующими эффектами:
- Анаболическим. Способствует образованию и регенерации поврежденной сердечной мышечной ткани, а также ЖКТ.
- Активизирует цикл Кребса, что приводит к улучшению дыхания на клеточном уровне.
- Ускоряет микроциркуляцию биологических жидкостей. Усиливает капиллярное кровообращение и транспортировку крови и лимфы, в результате чего область некротических изменений в миокарде при инфарктах становится меньше, риск развития ишемической болезни значительно понижается.
- Является участником энергетического обмена. Активный компонент Рибоксина оказывает влияние на обмен и утилизацию глюкозы – основного источника энергии, что обеспечивает нормальное прохождение любых процессов в организме.
- Улучшает обменные процессы при недостатке кислорода в тканях или отдельных органах.
Наибольшее воздействие препарат оказывает на миокард и печень. Активизация в органах обменных процессов приводит к:
- повышению устойчивости клеток к гипоксии;
- восстановлению нормального проведения электрических импульсов, в результате чего нормализуется сердечный ритм;
- улучшению кровоснабжения почек и сердечной мышцы, а также дыхания тканей;
- снижению риска образования тромбов;
- уменьшению агрегации тромбоцитов;
- увеличению сократимости миокарда;
- улучшению восстановительной способности миокарда после инфарктов;
- предупреждению хронической сердечно-сосудистой недостаточности и тромбоэмболии;
- восстановлению печени при патологических изменениях;
- лучшей регенерации тканей желудка при эрозивно-язвенном поражении.
Рибоксин не относится к препаратам с ярко выраженным эффектом, но совместно с другими лекарственными средствами его применение заметно улучшает состояние пациента.
Рибоксин применяется совместно с другими лекарственными препаратами для борьбы с:
Сердечно-сосудистыми патологиями:
- ишемией сердца;
- нарушениями сердечного ритма;
- интоксикацией, вызванной применением сердечных гликозидов;
- кардиомиопатиями;
- последствиями инфаркта миокарда;
- стенокардией;
- миокардитом, вызванным физическими перегрузками;
- врожденными и приобретенными пороками сердца.
Патологическими изменениями в печени:
- гепатитами;
- жировой дистрофией, спровоцированной чрезмерным употреблением алкоголя или лекарствами;
- циррозом.
Урокопропорфирией.
Открытоугольной глаукомой при нормальном внутриглазном давлении путем нормализации зрения.
Язвенными поражениями желудка и двенадцатиперстной кишки.
Лучевыми ожогами. Препарат способствует их скорейшему заживлению и не допускает уменьшения количества лейкоцитов в крови.

Хорошими отзывами Рибоксин пользуется у людей, занимающихся спортом, особенно силовыми видами
Нестероидное анаболическое средство спортсменами принимается совместно со стероидами преимущественно при занятиях бодибилдингом и пауэрлифтингом и приводит к:
- повышению эластичности сосудистых стенок;
- поддержанию уровня и пропускной способности гемоглобина;
- нормализации синтеза инсулина;
- поддержания мышцы сердца;
- стимуляции усваиваемости углеводов.
Применение препарата не влияет на рост силовых показателей и наращивание мышечной массы. Но восстанавливает углеводный, белковый и жировой обмены, приводит к повышению защитных свойств организма и увеличению эффективности тренировок.
Противопоказания
Противопоказания к применению Рибоксина могут быть абсолютными или относительными.
Применение Рибоксина однозначно не рекомендуется при наследственной или приобретенной непереносимости как основного, так и дополнительных составляющих лекарства или повышенной чувствительности к ним.

Немногочисленность противопоказаний и побочных эффектов, а также приемлемая цена Рибоксина позволяют его применять практически всем категориям пациентов
Так, если раствор для инъекций выпускается только на основе инозина (20 мг/л), то капсулы и таблетки производятся с содержанием активного компонента и:
- кальция стеарата;
- картофельного крахмала;
- сахарной пудры;
- смеси, покрывающей твердую дозированную лекарственную форму: Индигокармина (Е 132), диоксида титана (Е 171), Макрогола (полиэтиленгликоля 3000), оксида железа (Е 172), Хинолинового желтого (Е 104).
Подагрический артрит
Основной активный компонент Рибоксина – инозин, участвует в метаболизме пуринов, при разрушении которых образуется мочевая кислота. Данный процесс не является аномальным.
Однако высокие дозировки Рибоксина, его употребление на протяжении длительного времени преимущественно в виде внутривенных инъекций провоцирует существенный подъем уровня мочевой кислоты и отложению ее в различных тканях организма, особенно в сухожилиях, суставах. Данное накопление вещества приводит к метаболическому заболеванию – подагрическому артриту (подагре).
Неконтролируемый прием Рибоксина в редких случаях провоцирует рецидивы или обострение заболевания.
Гиперурикемия
Гиперурикемия (повышенный уровень мочевой кислоты в плазме крови) также является противопоказанием для приема Рибоксина.
Чрезмерное количество вещества в организме при применении лекарственного препарата приводит не только к возникновению приступов подагры, но и к почечной недостаточности при блокировании кристаллами мочевой кислоты почечных канальцев.
Влияние Рибоксина на количество мочевой кислоты вызывает необходимость его применения осторожно и под контролем врача при почечных заболеваниях или прохождении курса химиотерапии. Прием лекарственного средства должен осуществляться при регулярных проверках мочевой кислоты в моче и крови пациента.
Диабет
Существует мнение, что сахарный диабет является противопоказанием для применения Рибоксина. Однако в инструкции по применению препарата ничего об этом не сказано.
С одной стороны, устраняя гипоксию тканей, которая часто наблюдается у диабетиков при гипогликемии, препарат может принести только пользу. С другой стороны, увеличение показателей мочевой кислоты вследствие употребления Рибоксина способствует повышению резистентности организма к инсулину, что крайне нежелательно.
При сахарном диабете любое лекарственное средство должно применяться под контролем специалистов. Рибоксин не составляет исключения. Только после определения соотношения пользы и вреда от препарат может быть включен в состав терапии.
Также применение средства не рекомендуется при непереносимости лактозы и фруктозы, нарушенном усвоении глюкозы, галактозы, а также в случае дефицита сахарозы или изомальтазы.
Артериальное давление
Прямого влияния на артериальное давление Рибоксин не оказывает, и специалисты считают нецелесообразным применение данного лекарственного препарата для нормализации его показателей.
Однако улучшая обменные процессы в организме, лекарственное средство косвенно приводит к его снижению.
Гипотония не является абсолютным противопоказанием к применению препарата, но вызывает осторожность в его использовании.
Беременность и детский возраст пациента
Несмотря на отсутствие клинических исследований о воздействии препарата на организм кормящих и беременных женщин, назначение Рибоксина в этот период наблюдается часто.
Средство способно преодолевать плацентарный барьер, но его токсическое воздействие на организм будущего ребенка до настоящего времени не выявлено. Препарат:
- улучшает мышечное формирование плода;
- устраняет гипоксию плода;
- применяется для лечения тяжелых форм плацентарной недостаточности.
Применение лекарственного средства будущими мамами может быть обусловлено повышенным риском развития ишемии и сердечной недостаточности:
- ожирением;
- асоциальным образом жизни;
- недостаточным или некачественным питанием;
- курением или злоупотреблением алкоголем и др.
Также отсутствуют данные о проникновении Рибоксина в грудное молоко и о влиянии его на организм малыша.
В инструкции по применению лекарственного средства запрещено его употребление до достижения пациентом возраста 18 лет из-за отсутствия данных о его эффективности и безопасности в детском возрасте.
Стоит учесть, что Рибоксин несовместим с витамином В6, кислотами, пиридоксина гидрохлоридом и спиртом.
Побочные эффекты
В редких случаях Рибоксин приводит к возникновению побочных воздействий, которые проявляются:
- аллергическими реакциями в виде высыпаний на кожных покровах, гиперемии, зуда;
- понижением показателей артериального давления;
- повышением концентрации мочевой кислоты в организме;
- учащенным сердцебиением;
- обострением подагрического артрита;
- учащенным сердцебиением;
- головокружением и стойкой головной болью;
- усиленным потоотделением;
- анафилактическим шоком.

При появлении побочных эффектов необходимо прекратить употребление лекарственного средства
При инъекционном вводе препарата не исключены местные реакции виде покраснения и зуда в месте укола.
Во избежание побочных действий Рибоксина его применение должно быть согласовано с лечащим врачом.
Отзывы
Алексей Михайлович Муранов, врач-кардиолог (г. Харьков)
Современная медицина имеет в своем распоряжении более эффективные средства, чем Рибоксин. Лекарство довольно популярно, имеет невысокую цену и редко возникающие незначительные побочные эффекты, противопоказаний также мало. Назначают, когда серьезной болезни не выявлено, чаще для эффекта плацебо.
Анатолий Васильевич Смирнов, Омск, 60 лет
С детства занимался тяжелой атлетикой на профессиональном уровне. Тренеры с разрешения врачей всегда назначали Рибоксин не только мне, но и другим спортсменам. Считалось, что препарат намного повышает выносливость. Лично я при постоянных тренировках яркого эффекта от лекарства никогда не замечал, но никаких побочных эффектов не было.
Светлана, Белгород, 48 лет
Соседка посоветовала для поддержки деятельности сердца пропить Рибоксин. Лекарство популярное, дешевое, доступное. С врачом, конечно, не посоветовалась. Принимала одна таблетку трижды в сутки до еды в течение недели. Потом на коже появились бледно-розовые высыпания, которые сильно чесались. Врачи диагностировали крапивную сыпь, которая явилась побочным действием лекарства. Как только бросила его принимать, сыпь прошла.
Источник
